Enhavo
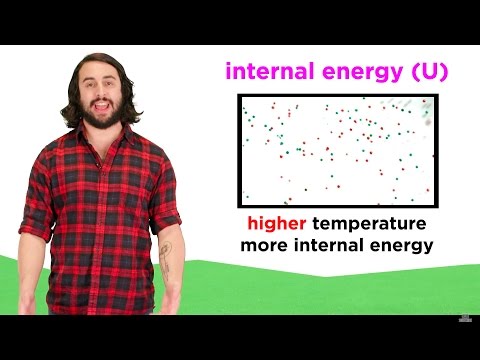
La interna energioLaŭ la Unua Principo de Termodinamiko, ĝi estas komprenata kiel tiu ligita al la hazarda movado de partikloj ene de sistemo. Ĝi diferencas de la ordigita energio de makroskopaj sistemoj, asociitaj kun moviĝantaj objektoj, ĉar ĝi rilatas al la energio enhavita de objektoj sur mikroskopa kaj molekula skalo.
A) Jes, objekto povas ripozi tute kaj malhavi ŝajnan energion (nek potenciala, nek kineta), kaj tamen plenumi moviĝantajn molekulojn, moviĝante je altaj rapidoj sekunde. Fakte, ĉi tiuj molekuloj allogos kaj forpuŝos unu la alian laŭ siaj kemiaj kondiĉoj kaj mikroskopaj faktoroj, kvankam ne estas observebla movado al nuda okulo.
Interna energio estas konsiderata vasta kvanto, tio estas rilata al la kvanto de materio en donita partikla sistemo. Tiam konsistas el ĉiuj aliaj formoj de energio elektra, kineta, kemia kaj potenciala enhavita en la atomoj de donita substanco.
Ĉi tian energion kutime reprezentas la signo A..
Interna energia variado
La interna energio de partiklosistemoj povas varii, sendepende de ilia spaca pozicio aŭ akirita formo (en la kazo de likvaĵoj kaj gasoj). Ekzemple, enkondukante varmon al fermita sistemo de partikloj, aldoniĝas termika energio, kiu influos la internan energion de la tuto.
Tamen, interna energio estas astatusa funkcio, tio estas, ĝi ne atentas la variadon, kiu ligas du materiaj statoj, sed sian komencan kaj finan staton. Tial la kalkulo de la variado de la interna energio en donita ciklo ĉiam estos nulaĉar la komenca stato kaj la fina stato estas unu sama.
La formuloj por kalkuli ĉi tiun variaĵon estas:
ΔU = UB - A ORAL, kie la sistemo iris de ŝtato A al stato B.
ΔU = -W, en kazoj, kiam kvanto da me mechanicalanika laboro W estas farita, kio rezultas en la ekspansio de la sistemo kaj la malpliigo de ĝia interna energio.
ΔU = Q, en la kazoj, en kiuj ni aldonas varmenergion, kiu pliigas la internan energion.
ΔU = 0, en la kazoj de ciklaj ŝanĝoj de la interna energio.
Ĉiuj ĉi tiuj kazoj kaj aliaj povas esti resumitaj en ekvacio, kiu priskribas la Principon de Konservado de Energio en la sistemo:
ΔU = Q + W
Ekzemploj de interna energio
- Baterioj. La korpo de ŝarĝitaj baterioj enhavas uzeblan internan energion, danke al la kemiaj reakcioj inter acidoj kaj pezaj metaloj interne. Ĉi tiu interna energio estos pli granda kiam ĝia elektra ŝarĝo finiĝos kaj malpli kiam ĝi estos konsumita, kvankam en la kazo de reŝargeblaj kuirilaroj ĉi tiu energio povas esti pliigita denove enkondukante elektron de la elirejo.
- Kunpremitaj gasoj. Konsiderante, ke gasoj emas okupi la tutan volumon de la ujo, en kiu ili estas enhavitaj, ĉar ilia interna energio varios, ĉar ĉi tiu spaco estas pli granda kaj pliiĝos kiam ĝi estos malpli. Tiel, gaso disigita en ĉambro havas malpli internan energion ol se ni kunpremas ĝin en cilindro, ĉar ĝiaj eroj estos devigitaj interagi pli proksime.
- Pliigu la temperaturon de materio. Se ni pliigas la temperaturon de ekzemple gramo da akvo kaj gramo da kupro, ambaŭ ĉe baza temperaturo de 0 ° C, ni rimarkos, ke malgraŭ esti la sama kvanto da materio, la glacio postulos pli grandan kvanton de totala energio por atingi la deziratan temperaturon. Ĉi tio estas ĉar ĝia specifa varmeco estas pli alta, tio estas, ĝiaj eroj malpli akceptas la enkondukitan energion ol tiuj de kupro, aldonante varmon multe pli malrapide al ĝia interna energio.
- Skuu likvaĵon. Kiam ni solvas sukeron aŭ salon en akvo, aŭ ni antaŭenigas similajn miksaĵojn, ni kutime skuas la likvaĵon per instrumento por antaŭenigi pli grandan dissolvon. Ĉi tio ŝuldiĝas al la pliigo de la interna energio de la sistemo produktita de la enkonduko de tiu kvanto de laboro (W) donita de nia ago, kiu permesas pli grandan kemian reaktivecon inter la koncernaj partikloj.
- Vaporode akvo. Post kiam la akvo estas boligita, ni rimarkos, ke la vaporo havas pli altan internan energion ol la likva akvo en la ujo. Ĉi tio estas ĉar, malgraŭ esti la sama molekuloj (la komponaĵo ne ŝanĝiĝis), por indukti la fizikan transformon, ni aldonis certan kvanton da kaloria energio (Q) al la akvo, kaŭzante pli grandan agitiĝon de ĝiaj eroj.
Aliaj specoj de energio
| Potenciala energio | Mekanika energio |
| Hidrelektra energio | Interna energio |
| Elektra energio | Termika energio |
| Kemia energio | Suna energio |
| Venta potenco | Nuklea energio |
| Kineta energio | Sonenergio |
| Kaloria energio | hidraŭlika energio |
| Geoterma energio |